研究の概要
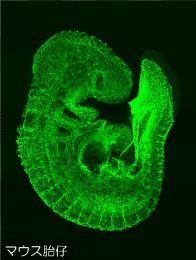 図1
図1
ヒトの体には、頭のてっぺんから足の先まで、隈なくびっしりと血管が張り巡らされております。全身の血管の長さを全て合わせると10万キロメートル(正確な数値に関しては議論の余地あり)、およそ地球2周半もの長さになると言われます。この10万キロメートルの血管ネットワークは、その膨大な長さにも拘らず、テレビやパソコンのコードのように絡み合うことは一切ありません。また、その走行に個人差は殆ど無く、みな似たようなパターンで全身に張り巡らされます。これは、よく考えればとても不思議な現象だと思いませんか?
ヒトの大人にみられる血管ネットワークは、妊娠初期に既にほぼ出来あがっています。受精卵からわずか3か月の間に、瞬く間にその構築が出来上がるのです。その様子はとてもダイナミックで、木が枝別れしつつ、上へ上へと伸びていく様子に似ています。
わたしたちの研究室は、この血管ネットワークが形作られるメカニズムを解き明かすべく、主にマウス(図1)を用いて研究を重ねております。わたしたちの研究の一番の特徴として、主に古典的な形態学的手法により、徹底的に「かたち」を観察することで、視覚に訴えるわかりやすい研究、つまり一枚の写真で納得してもらえるような研究を志しています。また、仮説ではなく、偶然の発見と日々の観察の積み重ねを最も大事にし、そこから未知の生命現象を解き明かそうと試みております。常にアウトプット・実用性が重視される昨今の生命科学・医学研究の時代の流れに逆行するようですが、流行に流されない骨太な研究を展開したいと考えております。
| プロジェクト1: 「血管構造の3次元可視化と組織・臓器ごとの多様性」 | プロジェクト2: 「酸素濃度と血管発生」 |
|---|---|
| プロジェクト3: 「炎症細胞と血管新生」 | プロジェクト4: 「なぜ特定の組織には血管が入っていかないのか?」 |
| プロジェクト5: 「リンパ管の発生と解剖」 |
プロジェクト1: 「血管構造の3次元可視化と組織・臓器ごとの多様性」
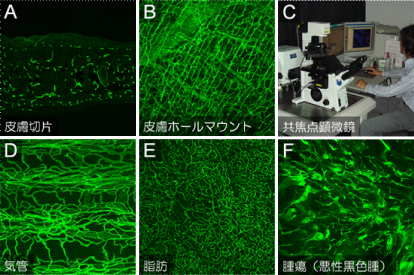 図2
図2
血管を研究する上で最も重要なのは、生体内における血管をできる限りそのままの形で観察することと考えます。血管構造を可視化するプロセスとして、これまでの長い血管研究の歴史において、組織切片を作成し、血管に特異的な抗体を用いて検出するという手法がとられてきました。しかしながら切片では、血管の横断面、または索状構造しか観察されず、ネットワーク構造の全体像を把握することは困難でした(図2A)。わたしたちはこれを克服すべく、従来マウス胎仔で行われてきた、いわゆるホールマウント染色の技術に改良を加え、共焦点顕微鏡を用いて(図2C)、成獣マウスのいろいろな臓器の血管を3次元的に可視化する技術を開発してきました。このホールマウント染色の技術では、切片ではよくわからなかった血管ネットワークの全体像を一目で把握することができ(図2B)、また臓器ごとに異なる血管パターニングの多様性がとてもよくわかります(図2D, E, F)。この臓器ごとの血管ネットワークの多様性の意義・獲得機構は本研究室の大きなテーマの一つとなっております。従来の血管研究においては、全身の血管発生を十把一絡げにvasculogenesis(脈管形成)、angiogenesis(狭義の血管新生)、remodeling(血管リモデリング)の3つにカテゴライズし、縦割り式に包括的に理解しようというスタイルが一般的でした。例えば、肝臓や筋肉で見つかった新たな血管新生メカニズムが他の臓器では存在しない場合、例外的な事象と見なされ、『一般的な血管新生メカニズム』から排除される傾向がありました。しかしながら、臓器の血管パターニングは臓器の実質細胞同様にかなり異なり、その多様性が如何にして生み出されるのかについては、上記3つの教科書的なカテゴライズでは説明できません。本研究室では、もともと組織によって血管新生メカニズムは全く違うものであることを前提とし、それをベースとして共通項や相反する点を見出すことで、より大きな枠組みで物事を捉え、血管形成の本質を解き明かしたいと考えております。
プロジェクト2: 「酸素濃度と血管発生」
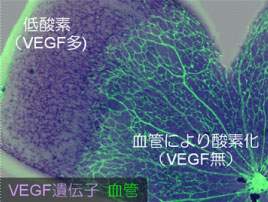 図3
図3
そもそもヒトの体にとって、なぜ血管は必要なのでしょうか?血管が無いと、ヒトの体はどうなってしまうのでしょうか?心臓からでた血液は血管を通じて、全身にいきわたり、全身の組織に酸素・栄養を供給します。もしこの血管から供給される酸素が不足すると組織は生きていけません。発生過程において、肝臓や脳、肺などの臓器に分布する血管ネットワークがうまく出来ないと、それらの臓器自体が正常にできてこないことはよく知られております。また、成人になってから、例えばなんらかの原因で下肢の動脈が閉塞すると、酸素・栄養不足により足先の組織壊死が起こることがあります。つまり血管は全身に酸素・栄養を運搬し、臓器を育て、維持するためのパイプラインということになります。
酸素濃度、これは血管網が形作られる過程において特に重要な要素となります。低酸素状態にある細胞では低酸素誘導因子(HIF; Hypoxia-inducible factor)が活性化されます。このHIFの作用により、周囲から血管を呼び込み、増殖させる作用のある血管内皮細胞成長因子(VEGF; Vascular endothelial growth factor)が分泌されます。これにより低酸素組織ではVEGFが多量に存在する状態となり、周囲からその組織にむかって血管が伸びていきます。こうしてできた血管から酸素が供給され、その組織の低酸素状態が解消されます。わたしたちの研究室はマウス網膜を題材に、前項(プロジェクト1: 「血管構造の3次元可視化と組織・臓器ごとの多様性」)の技術を使って、このプロセスの詳細を具に観察してきました(図3)。その結果、神経細胞、グリア細胞、血管内皮細胞が、酸素濃度を軸として相互に作用しあうことで、VEGF発現の密度・分布の適切なバランスをとり、方向性を持った血管の成長を可能としていること(図3B)がわかってきました(Kubota et al J Clin Invest 2008; Kurihara et al Development 2010; Nakamura-Ishizu et al Dev Biol 2012)。
プロジェクト3: 「炎症細胞と血管新生」
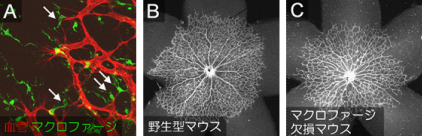 図4
図4
前項(プロジェクト2: 「酸素濃度と血管発生」)で述べたように、血管は周囲の細胞とともに、網膜においては神経細胞やグリア細胞との共同作業によりネットワークを構築します。その中で、わたしたちが特に着目しているのが炎症細胞の一つとして知られるマクロファージです。マクロファージはその免疫における役割で有名ですが、実は血流が開始していない胎生初期から全身に存在し、また高度な免疫機能を持たないミジンコやホヤなどの下等生物にも存在します。わたしたちはこの全身のマクロファージの綿密な形態学的観察の中で、免疫だけではなく発生期の血管ネットワーク形成にも関与することを世界で初めて証明しました(Kubota et al J Exp Med 2009)。前々項(プロジェクト1: 「血管構造の3次元可視化と組織・臓器ごとの多様性」)の技術を用いて、マウスの発生期網膜を観察したところ、マクロファージは成長過程にある血管と血管の隙間に存在し、手を伸ばして血管と血管をつなげている様子が観察されました(図4A矢印)。実際、マクロファージがいない変異マウス(Csf1op/opマウス)の血管を解析したところ、血管の枝分かれが明らかに減っていることがわかりました(図4B, C)。つまりマクロファージは血管と血管をつなげて新たな枝分かれ構造をつくる橋渡し(Bridging)の役目を担っているのです。現在、この胎生初期から現れる各臓器のマクロファージの起源、そしてどのようなメカニズムで血管の橋渡しに寄与しているかについて解析しております。
プロジェクト4: 「なぜ特定の組織には血管が入っていかないのか?」
(プロジェクト1: 「血管構造の3次元可視化と組織・臓器ごとの多様性」)でも述べましたが、わたしたちヒトの体の血管は臓器によってそのパターニングがかなり異なります。この血管ネットワークの多様性・可塑性は、各臓器の機能の発揮のための重要なシステムの一つであると考えられます。では、如何にしてこの多様性は獲得されるのでしょうか?本研究では、血管が伸びるメカニズムよりむしろ、血管が特定の局所には伸びないメカニズムこそが臓器・組織特異的血管パターニングの本質であるというアプローチにより、これを理解しようと試みております。
脳や網膜などの中枢神経系組織では、臓器の表面(脳における軟膜、網膜における神経線維層)に動静脈を有する密なネットワークが形成される一方、臓器の内部にはわずかの毛細血管が分布されるとのみであるという事象が知られております。これは、神経細胞の活発な酸素消費、代謝活動を考慮すると不思議な現象ですが、如何にしてこのようなパターンがとられるかは不明でした。わたしたちは、あらゆる血管新生に必須の分子であるVEGFの受容体が、網膜においては血管よりむしろ神経に強く発現するという意外な発見をきっかけに、VEGFタンパクが神経によって取り込み・消化(エンドサイトーシス)されることで、神経方向への血管の伸長が制限されていることを見出しました(図5)(Okabe et al Cell 2014)。このメカニズムは、網膜内部への血管進入の量を制限しているだけではなく、胎生期一過性血管(硝子体血管)の退縮のタイミングをも制御していることを見出しました(Yoshikawa et al J Exp Med 2016)。本研究は、中枢神経系特有の血管パターニング(臓器内部に太い血管を配置しないことで、神経細胞の微細な活動を妨げない)の獲得機構を説明するとともに、これまでの転写やタンパク合成などとは独立した、VEGFの制御機構に関する新たな側面を提示しています。
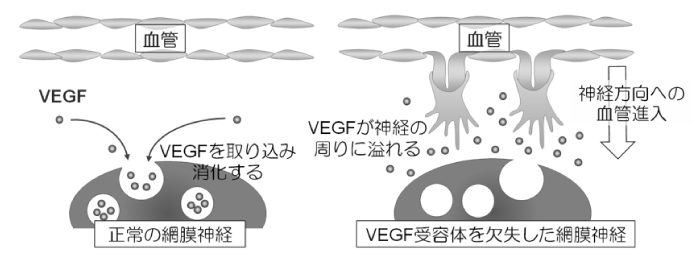 図5
図5
プロジェクト5: 「リンパ管の発生と解剖」
人体における2大ネットワークである血管とリンパ管は、別々のネットワークを全身に張り巡らせ、独立した機能を発揮します。血管は主に肺から取り入れた酸素を末梢組織に運搬し、組織に受け渡します。一方、リンパ管は血管が回収しきれなかった組織液を取り込むとともに、抗原提示細胞のリンパ節への経路、つまり免疫システムの一部として働きます。血管とリンパ管は、最終合流地点である頸部の静脈角(胸管と鎖骨下静脈の吻合部位)まで一切接続すること無く、各々が独立したネットワークを形成します。毛細リンパ管から回収された組織液は、集合リンパ管へと集められ、リンパ節や乳糜槽などを経て静脈角から血管に回収されます。
本研究室では、このリンパ管の発生に関して興味深い知見を得ております(Tai-Nagara et al., Nature Communications 2020)。多発性肺嚢胞、腎がん、線維毛包種などを典型的症状とするBirt-Hogg-Dubé(BHD)症候群の原因遺伝子として知られるフォリクリン(Flcn)の血管特異的ノックアウトマウスを作成したところ、血管とリンパ管がところどころで接続し(異常吻合)致死となる表現型を見出しました。そのメカニズムとして、Flcnはリンパ管発生のマスター転写因子であるProx1の発現量を負に制御していること、また、血管内皮細胞でFlcnが欠失すると Prox1が発現しリンパ管に類似した『リンパ管もどき静脈内皮細胞』となり、このような細胞が生じた血管はリンパ管を接続すべき対象と認識してしまうことを見出しました。また、このメカニズムの詳細として、Flcnによって核内移行が抑制される転写因子TFE3はProx1の制御領域に結合し、Prox1の発現を直接制御していることを見出しました(図6)。本研究成果は不明なところの多かったProx1の制御機構を明らかにしただけではなく、血管・リンパ管という体内の2つの酷似する循環系が、なぜ一切交通することなく、独立したネットワークを形成するのかという、解剖学的、発生学的に重要な疑問を解き明かしたという学術的重要性を持ちます。
また、リンパ管の研究の歴史は比較的浅く、解剖学的にも血管に比べて不明な点が多く残されています。たとえば、上記静脈角における血管とリンパ管の吻合部位の詳細な構造は、ヒトでもマウスでもあまりよくわかっていないのが実情です。本研究ではこの静脈角について、解剖学的にその構造を徹底的に解析し、その老化による変化、維持機構についても解き明かそうとしております。
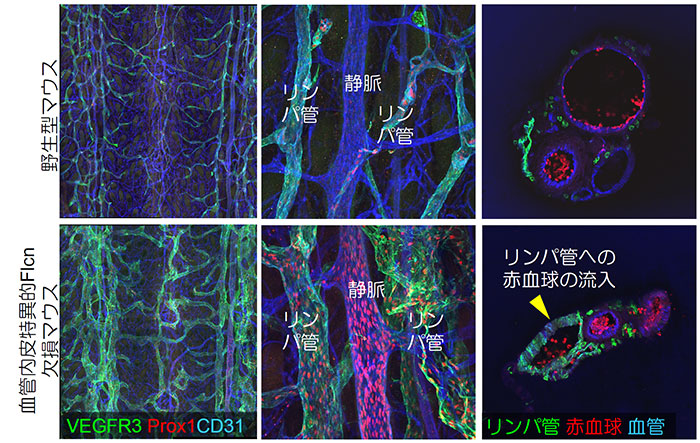 図6
図6

